Miranza Instituto Gómez-Ulla
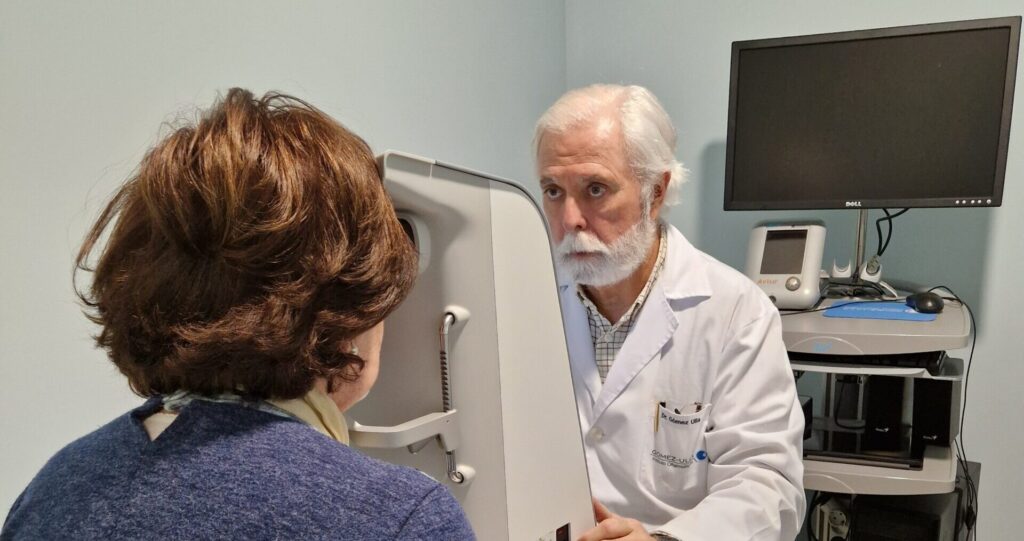
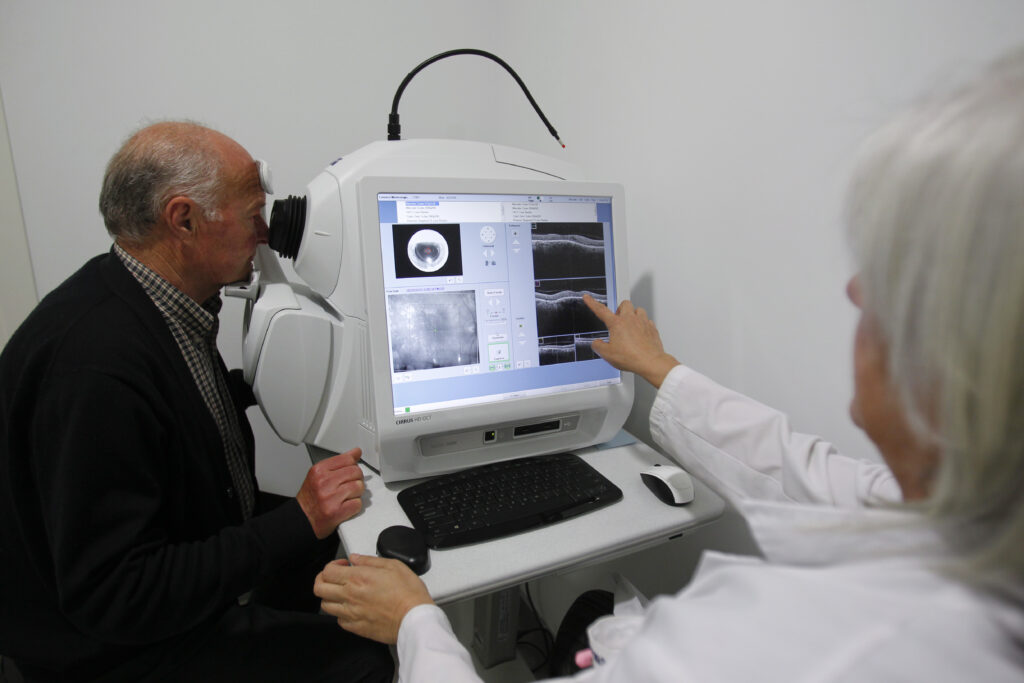
Miranza Instituto Gómez-Ulla cuenta con 40 años de experiencia en la prevención, diagnóstico y tratamiento de las enfermedades oculares. Somos una clínica referente a nivel nacional e internacional en el campo de la visión y ofrecemos un servicio de atención integral al paciente a nivel clínico y quirúrgico, combinando la labor asistencial con la investigación clínica, la formación, la docencia y la responsabilidad social corporativa. Bajo la dirección médica del Prof. Francisco Gómez-Ulla, el equipo de oftalmólogos, optometristas, enfermeras y auxiliares de enfermería se ocupa de velar por la salud ocular de los pacientes. Su alta cualificación hace que actualmente el Centro Miranza Instituto Gómez-Ulla sea referencia tanto a nivel autonómico como nacional e internacional en un amplio espectro de enfermedades de la visión.
2.400 m2
al servicio de la oftalmología
15
unidades especializadas por patologías
+40 años
de experiencia en prevención, diagnóstico y tratamiento oftalmológico
Nuestras instalaciones
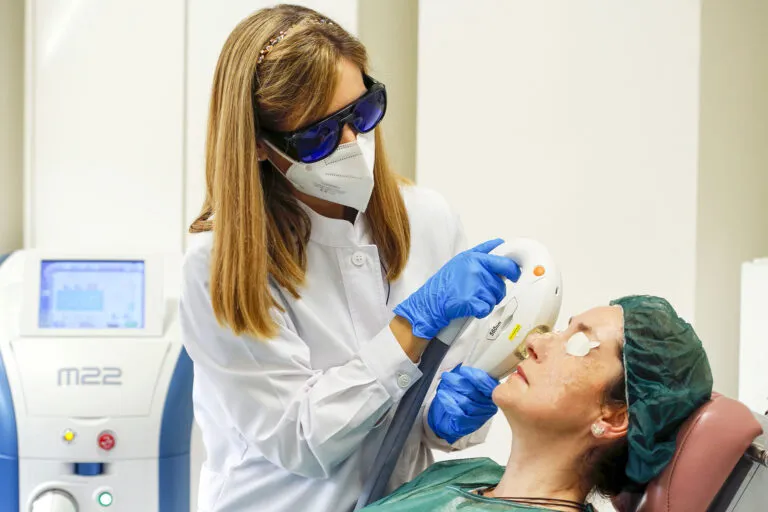
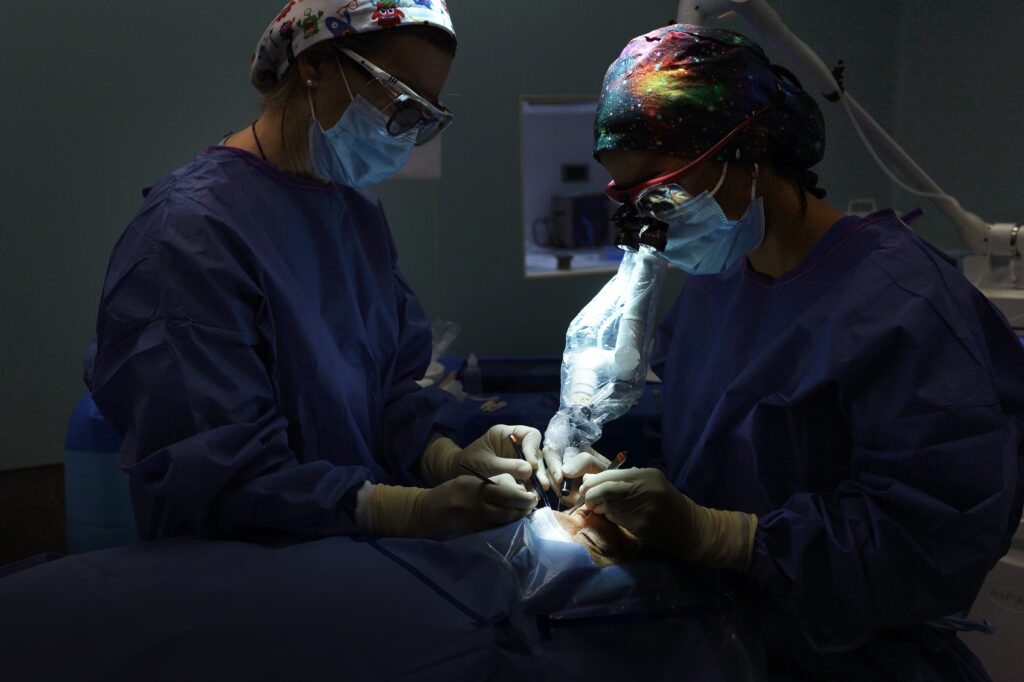
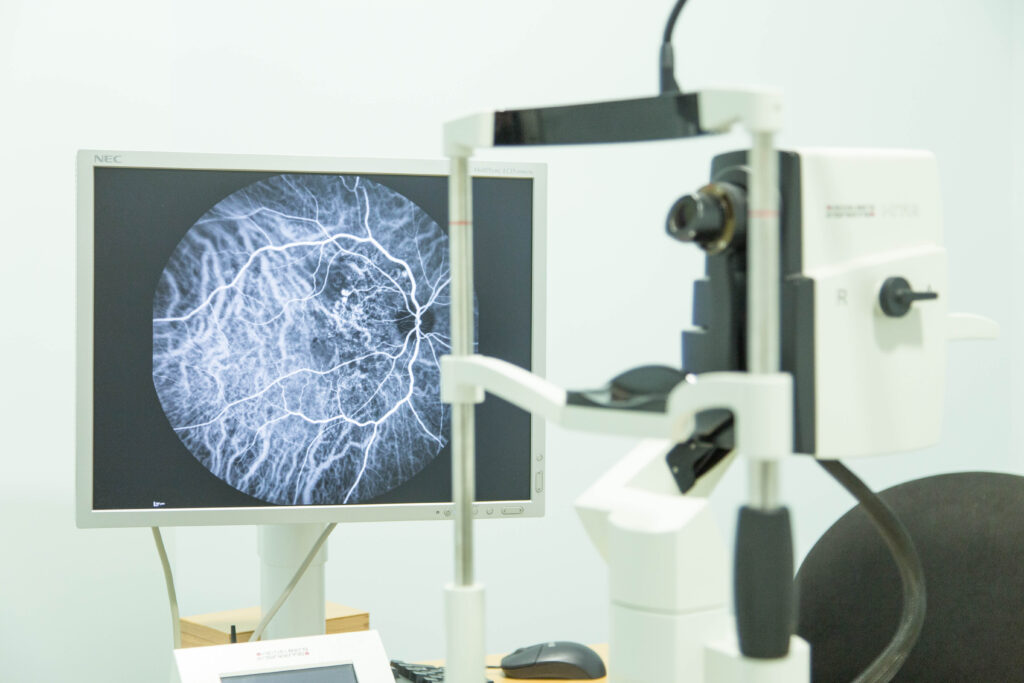
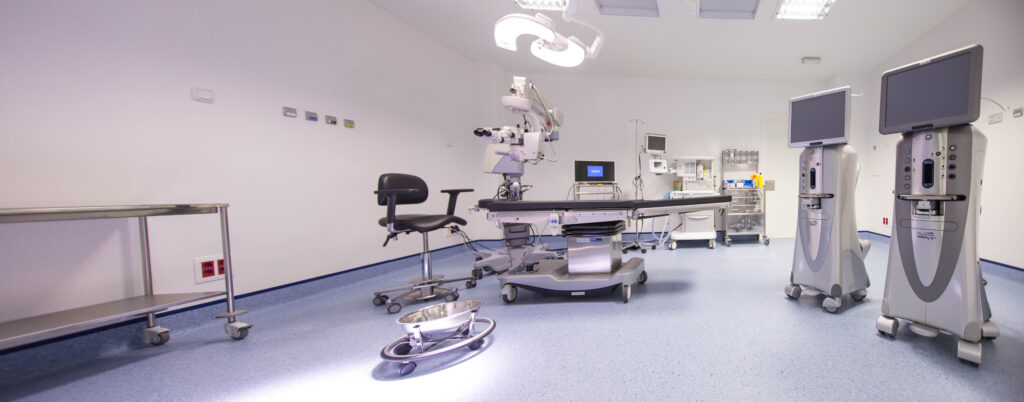
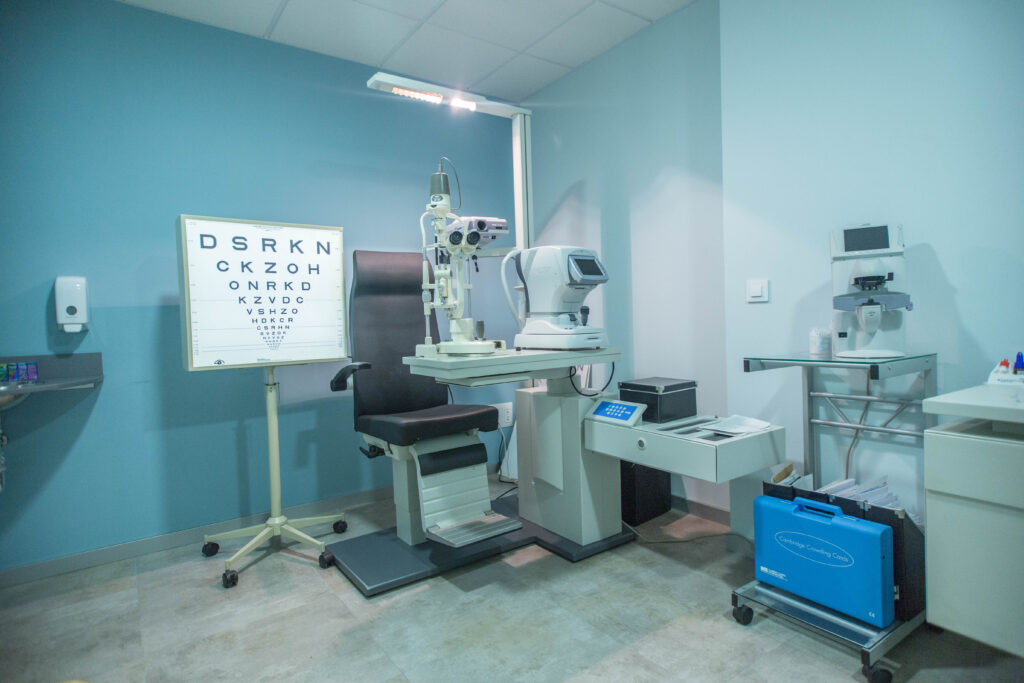
Ubicado en Santiago de Compostela, Miranza Instituto Gómez-Ulla cuenta con instalaciones médicas y quirúrgicas equipadas con la tecnología más avanzada en oftalmología, garantizando la mejor atención y servicio al paciente. Con 2.400 m2 a disposición de los pacientes, el instituto dispone de 15 unidades especializadas por patología y 2 quirófanos. Además de parking propio y gratuito para pacientes.
Compañías de seguros y financiación
Colaboramos con las compañías aseguradoras y mutuas médicas más importantes: Adeslas, Aegon, Allianz, Asepeyo, Asisa, Asiser, Avantsalud, Axa, CanalSalud24, Cigna, Cosalud, DKV, Grupo Ocaso, Hércules Salud, Hna, Ibermuta, Legálitas Salud, Mapfre, MC Mutual, Mutua Universal, MPS Unión Protectora Santiago de Compostela, Nara Seguros, Ocaso, Reale, Sanitas, Santalucía Seguros, Unión Madrileña de Seguros, Unión Artesanos y Verisalud.
Equipo Miranza Instituto Gómez-Ulla
Bajo la dirección del Prof. Francisco Gómez-Ulla de Irazazábal, con una sólida experiencia en oftalmología y destacada gestión de equipos médicos, Miranza Instituto Gómez-Ulla se dedica a proporcionar atención personalizada y profesional para el cuidado visual. Para ello cuenta con 29 profesionales de la salud oftalmológica, entre oftalmólogos, optometristas, enfermeras y auxiliares de enfermería.
Datos de contacto
Lunes a viernes
9:00h a 20:00h
Sábados (bajo cita previa)
10:00h a 14:00h
De 9h a 20h
 Dónde estamos
Dónde estamos